بحث عن التفاعلات الكيميائية وورد doc

هي عبارة عن تكسير روابط في المواد المتفاعلة لإنتاج روابط جديدة في المواد الناتجة مما يؤدي إلى تكوين مواد جديدة مختلفة في صفاتها الكيميائية والفيزيائية معاً.
التفاعلات الكيميائية
تشمل تغير ترتيب الذرات في الجزيئات الكيميائية ،و في مثل هذا التفاعل نشهد اتحاد بعض الجزيئات بطرق أخرى لتكوين شكل من مركب أكبر أو أعقد، أو تفكك المركبات لتكوين جزيئات أصغر، أو إعادة ترتيب الذرات في المركب. والتفاعلات الكيميائية تشمل عادة تكسر أو تكوين روابط كيميائية.
- تفاعلات أكسدة-إختزال
تفاعلات أكسدة-اختزال
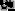
تمثيل لعملية أكسدة-اختزال
تفاعلات أكسدة-اختزال أو أكسدة-إرجاع
هي جميع التفاعلات الكيميائية التي يحدث فيها تغير في عدد أكسدة ذرات المواد المتفاعلة بسبب انتقال الإلكترونات فيما بينها.
يمكن أن تكون عملية الأكسدة-الاختزال عملية بسيطة مثل أكسدة الكربون ليعطي ثنائي أكسيد الكربون، أو إرجاع الكربون بالهيدروجين ليعطي الميثان، كما يمكن أن تكون عملية معقدة مثل أكسدة السكر في جسم الإنسان حيث تتضمن سلسلة معقدة من الانتقالات الإلكترونية.
- الأكسدة هي عملية فقدان للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات.
- الاختزال هي عملية اكتساب للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات.
وبتعريف أدق يمكن وصف عملية الأكسدة بالنسبة لعنصر ما (أو لجزيء يحوي عنصر تجري عليه هذه العملية) بأنها زيادة في عدد أكسدة هذا العنصر، في حين أن الاختزال (أو الإرجاع) هو النقصان في عدد الأكسدة.
مثال
وكمثال على هذه التفاعلات، التفاعل بين الحديد وكبريتات النحاس:

حيث ان التفاعل الأيوني هو:

حيث أن الحديد يتأكسد (عدد أكسدة الحديد ازداد من 0 إلى +2) :
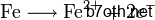
والنحاس يختزل (عدد أكسدة النحاس تناقص من +2 إلى 0) :
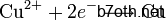
تم الاسترجاع من “
- تفاعل الاحتراق.
أنماط التفاعلات
يمكن تصنيف التفاعلات الكيميائية بطرق مختلفة تعتمد على ناحية معينة من نواحي التفاعل يتم التقسيم على أساسها، أو على أساس الفرع الكيميائي الذي تندرج ضمنه. بعض الأمثلة للمصطلحات المستخدمة لوصف الأنواع الشائعة من التفاعلات :
- تزامر Isomerisation، وفيه يخضع المركب الكيميائي لإعادة ترتيب بنيوية بدون تغيير في تركيبه الذري : انظر تزامر فراغي stereoisomerism.
- اتحاد مباشر Combination reaction أو اصطناع وفيه يتم انماج مركبين كيميائين أو أكثر ليشكلا مركبا كيميائيا واحدا معقدا.
2H2 (g) + O2 (g) → 2H2O (l)
- تفكك كيميائي : أو تحليل : وفيه يتم تفكيك المركب الكيميائي إلى مركبات أصغر أو عناصر كيميائية :
2H2O (l) → 2H2 (g) + O2(g)
- تفاعل استبدال أحادي Single displacement reaction : وفيه يتم استبدال عنصر من مركب كيميائي بعنصر آخر أكثر فعالية.
2Na(cr) + 2HCl (aq) → 2NaCl (aq) + H2 (g)
- تفاعل استبدال ثنائي Double displacement reaction أو استبدال مقترن coupling substitution، وفيه يقوم مركبين كيميائيين في محلول مائي (عادة يكونان بشكل شاردي) بتبادل عناصر أو أيونات من مركبات مختلفة.
NaCl (aq) + AgNO3 (aq) → NaNO3 (aq) + AgCl (s)
- احتراق Combustion : وفيه تقوم مادة قابلة للاحتراق بالاتحاد مع عنصر مؤكسد لينتجا حرارة ومركب مؤكسد (بفتح السين)
C10H8 (g) + 12O2 (g) → 10CO2 (g) + 4H2O (l)
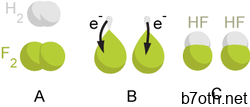
CH2S + 6 F2 → [[رباعي فلور المستطيل
الكربون|CF4]] + 2 HF + SF6 + حرارة
بعض فروع الكيمياء تعتبر أي تغيرات ضئيلة في التشكيل الكيميائيchemical conformation بمثابة نوع من أنواع التفاعل، في حين يعتبره آخرون مجرد تغير فيزيائي.
أنواع أخرى :
- تفاعلات عضوية
ا حسب تكافؤية العناصر التي تدخل في آليتها :
- تفاعل شاردي (أيوني)
- تفاعل جذري (جذور كيميائية)
- تفاعل الكاربين carbene
يمكن تصنيف التفاعلات أيضا حسب اتجاه سير التفاعل:
- تفاعلات تامة (أي تتحول جميع المتفاعلات إلى نواتج بعد زمن معين طال أو قصر)
- تفاعلات انعكاسية (لا تتم حتى نهايتها، ويتواجد جزء من المتفاعلات إلى جانب النواتج في اناء التفاعل مهما طال الوقت)
__________________________________
اضغط الرابط أدناه لتحميل البحث كامل ومنسق جاهز للطباعة


